Una Luz de Esperanza
En vivo
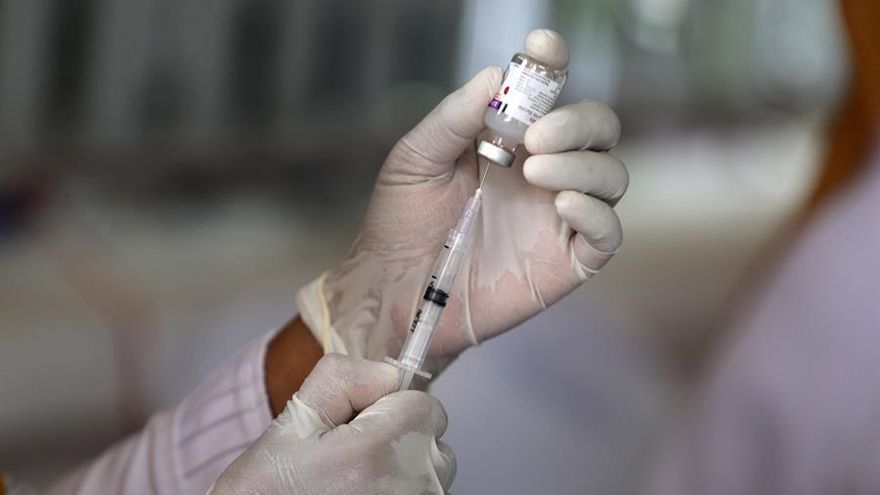
Lima/El laboratorio Pfizer y BioNTech anunciaron que suministrarán a Perú 9,9 millones de dosis de su vacuna candidata contra el SARS-CoV-2 basada en el programa BNT162 ARNm para ser aplicada en el país en cuanto sea aprobada por las autoridades competentes.
El acuerdo entre los laboratorios y el Ministerio peruano de Salud establece que el suministro de la vacuna candidata, que está en la fase 2 de ensayo de seguridad y eficacia, se realizará progresivamente hasta el 2021.
El costo económico de este acuerdo no fue revelado.
"Nos sentimos profundamente honrados de trabajar con el gobierno de Perú y de orientar nuestros recursos científicos y de producción hacia nuestro objetivo común, proporcionando a los peruanos una potencial vacuna contra el COVID-19 lo más rápido posible", indicó Erika Pagani, Gerente General de Pfizer Perú, Ecuador y Bolivia, en un comunicado de la compañía.
Por su parte, el Director de Negocios y Director Comercial de BioNTech, Sean Marett, extendió sus agradecimientos al gobierno peruano "por su apoyo y por confiar en nuestra capacidad para desarrollar una vacuna que, creemos, tiene el potencial para ayudar a enfrentar la amenaza global de esta pandemia".
"Nuestro objetivo sigue siendo mantener una provisión mundial de una vacuna contra el COVID-19 segura y eficaz para muchas personas en todo el mundo, lo más rápido posible", añadió Marett.
El programa BNT162 se basa en la tecnología de ARNm, patentada por BioNTech y respaldado por las capacidades globales de desarrollo y fabricación de vacunas de Pfizer.
En julio pasado, dos de las cuatro candidatas a vacunas que investigaban estas compañías, BNT162b1 y BNT162b2, recibieron la designación de Vía Rápida por parte de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA).
Esta designación se concedió sobre la base de datos preliminares de los estudios en fase 1/2 que se están llevando a cabo actualmente en Estados Unidos y Alemania, así como de estudios de inmunogenicidad animal.
A la espera del éxito de la vacuna, ambas compañías esperan poder solicitar aprobación regulatoria para fines de octubre del 2020, con el objeto de fabricar globalmente hasta 100 millones de dosis para finales de este año y aproximadamente 1.3 billones de dosis para finales del 2021.
Los dos laboratorios han manifestado además su interés en un posible suministro a COVAX Facility, el mecanismo establecido por la Alianza Mundial para la Vacunación (GAVI, por sus siglas en inglés), la Coalición para las Innovaciones en la Preparación ante Epidemias (CEPI) y la Organización Mundial de la Salud (OMS) para proporcionar a los gobiernos, incluidos los de mercados emergentes, un acceso temprano a una amplia cartera de vacunas candidatas COVID-19.
En julio pasado, Pfizer y BioNTech anunciaron que la vacuna candidata BNT162b2 pasaba a un estudio de fase 2/3.
La BNT162b2 codifica una glicoproteína pico de tamaño completo (S) del SARS-CoV-2 optimizada, que es el objetivo de los anticuerpos neutralizadores del virus.
En la última etapa del ensayo, las compañías estudiarán una dosis de 30 mg en un régimen de dos dosis entre 44.000 participantes de 16 a 85 años.
Se espera incluir aproximadamente 120 sitios en 3 países, incluyendo regiones donde se prevé una importante transmisión del SARS-CoV-2.
Perú es uno de los países más afectados por la pandemia de la COVID-19 a nivel mundial, con la tasa más alta de mortalidad, tras haber acumulado más de 31.000 fallecidos y 750.000 casos en seis meses de la enfermedad en el territorio peruano.
